Em setembro, a Anvisa publicou as Consultas Públicas no 1113/2022 e no 1114/2022 que tratam respectivamente de proposta de RDC sobre a regularização de alimentos e embalagens sob competência do Sistema Nacional de Vigilância Sanitária (SNVS) destinados à oferta no território nacional e proposta de Instrução Normativa (IN) que estabelece a forma de regularização das diferentes categorias de alimentos e embalagens, e a respectiva documentação que deve ser apresentada. A regularização do produto é sempre um tema de alta importância em Segurança de Alimentos, e já foi abordado diversas vezes pelo Food Safety Brazil, por exemplo, em “Produção e comercialização de alimentos artesanais – saiba por onde começar para regularizar o seu negócio” e em “Dúvida de leitor: vou iniciar a comercialização do molho que sirvo em meu restaurante, e agora?”, entre outros artigos. O assunto faz parte da Agenda Regulatória da Anvisa, como também foi antecipado aqui no blog em “Você já participou da Consulta Dirigida sobre a Agenda Regulatória 2021-2023 da Anvisa?”. O objetivo deste artigo é dar continuidade ao tema com informações sobre o processo regulatório e as principais mudanças previstas no projeto da Anvisa.
As ações para atualização das normas de regularização dos alimentos tiveram início em 2007 com a reunião das VISAs (Vigilâncias Sanitárias), quando foi discutida a primeira minuta da proposta. O projeto regulatório foi formalmente aberto em 2009 com a Consulta Pública no 95/2009, a qual foi parcialmente concluída com a publicação da RDC no 27/2010, que atualizou a lista de alimentos com obrigatoriedade de registro e isentos de registro. Entre as propostas da CP no 95/2009, a criação do processo de notificação com pagamento de taxa não evoluiu por gerar custos adicionais ao setor de produtivo e por impactar categorias isentas de registros que migrariam para a categoria de notificados.
Em 2011 foi aberto novo processo através da Consulta Pública no 52/2011, o qual também não foi concluído em decorrência da discussão das taxas, pois tal proposta estava na contramão das ações do governo para desoneração de microempreendedores. Em 2014 foi publicada a Lei no 13.001/2014 que trata da isenção de taxa para microempreendedores e agricultor familiar. Também em 2014, o texto da CP no 52/2011 foi reformulado e desmembrado na proposta de RDC e IN, e apesar de parecer favorável da Procuradoria sobre o pagamento de taxa para alimentos isentos de registro (notificados), a Diretoria da Anvisa (DICOL) solicitou a realização de testes no sistema de notificação, e o projeto não avançou. Entre 2015 e 2018, a Anvisa e a Gerência Geral de Alimentos (GGALI) passaram por reestruturação, outros projetos regulatórios foram priorizados na Agenda do órgão, e a atualização das normas de regularização permaneceu sem avanços. Além disso, foi identificada a necessidade de redefinição do problema regulatório e dos objetivos a serem alcançados com a revisão das normas de regularização de alimentos.
Como mencionado no início do artigo, o projeto de modernização do marco regulatório, fluxos e procedimentos para regularização de alimentos faz parte da Agenda Regulatória 2021-2023, e o processo foi novamente aberto em maio de 2022, o que resultou na publicação das Consultas Públicas no 1113/2022 e no 1114/2022. De acordo com o Painel de Acompanhamento dos Projetos Regulatórios, o projeto visa garantir tratamento proporcional ao risco à saúde dos produtos sujeitos à vigilância sanitária, além de dar celeridade, racionalidade e transparência para o processo de regularização, proporcionando acesso às inovações e mantendo a proteção da saúde dos consumidores. A Anvisa espera obter, dentre os resultados, a criação de regras proporcionais conforme os riscos associados às diferentes categorias de alimentos e grupo populacional a que se destinam, além de requisitos que mitiguem riscos referente a processo produtivo e qualidade. A Agência também almeja a definição inequívoca do rol de documentos necessários para regularizar cada categoria de produto, e maior integração das ações de controle sanitário pré e pós mercado.
Entre as principais mudanças propostas, está a criação de novo processo de regularização, adicional aos processos já existentes (registro e comunicado de início de fabricação ou de importação). Trata-se da notificação, peticionamento eletrônico realizado junto à Anvisa, sem necessidade de avaliação prévia do dossiê, válido por 2 anos, e realizado mediante pagamento de taxa somente na primeira submissão. A rotulagem do produto deve incluir a informação “Alimento notificado na Anvisa” seguido do número do processo de notificação. Cabe observar que, uma vez realizada a notificação, isso não significa que o produto está aprovado pelo órgão, mas o produto já pode ser ofertado após o protocolo, diferentemente do processo de registro. De acordo com a proposta da RDC, a notificação pode ser avaliada pela Anvisa a qualquer tempo, bem como a Agência pode requerer informações adicionais, solicitar correções ou cancelar a notificação. Essa proposta merece atenção, já que alguns alimentos atualmente sujeitos à comunicação de início de fabricação ou importação migrarão para o processo de notificação, o que impactará não somente o planejamento da documentação exigida para regularização, como também o orçamento do lançamento, visto que haverá pagamento de taxa.
Em relação ao processo aplicável às diferentes categorias para o registro de alimentos, há mudanças relevantes elencadas a seguir:
i. Registro obrigatório das fórmulas dietoterápicas para erros inatos do metabilismo, produto atualmente dispensado de registro;
ii. Notificação de todos os suplementos alimentares, incluindo os suplementos com probióticos e enzimas, os quais passarão de registrados para notificados, e os demais suplementos, que hoje são dispensados de registros e passarão a ser notificados;
iii. Notificação das embalagens recicladas PET-PCR, as quais atualmente são registradas;
iv. Notificação dos alimentos com alegações funcionais ou de saúde, os quais hoje são registrados;
v. Notificação de fórmula padrão para nutrição enteral e módulo para nutrição enteral, os quais hoje são registrados;
vi. Notificação dos alimentos de transição e cereais para alimentação infantil, atualmente registrados;
vii. Notificação dos alimentos para controle de peso, os quais atualmente são dispensados de registro;
viii. Notificação da água do mar dessalinizada, potável e envasada, que hoje é registrada;
ix. Comunicação de início de produção ou importação dos aditivos alimentares, que atualmente são dispensados de regularização.
O quadro abaixo traz as propostas de regularização de acordo com a categoria dos alimentos, e está disponível no Relatório de Análise de Impacto Regulatório.
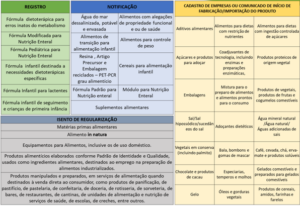
Em termos de impactos, cabe comentar que a categoria de fórmulas dietoterápicas para erros inatos do metabolismo, que passará a ser registrada, terá aumento de custos para sua regularização. Porém, categorias registradas que migrarão para o processo de notificação, tais como os alimentos com alegações funcionais, embalagens recicladas, suplementos alimentares com probióticos e enzimas, entre outras, terão redução dos custos para regularização, visto que o pagamento de taxa será realizado somente na primeira notificação, além da redução do cronograma para lançamento, pois os alimentos notificados não necessitarão aguardar análise prévia do dossiê pela Anvisa. Por outro lado, categorias que migrarão de dispensadas de registro para notificação também sofrerão aumento dos custos de regularização; é o caso dos suplementos alimentares (sem enzimas ou probióticos) e dos alimentos para controle de peso.
No que se refere à documentação exigida para os processos de regularização, a proposta de IN da CP no 1114/2022 está dividida em Anexos estruturados por tipo de processo (registro, revalidação de registro, alterações pós registro, notificação, comunicado de início de fabricação ou importação) e por categoria de produto. Cabe destacar que, dentre a documentação exigida para a regularização dos alimentos, está bastante clara na proposta a obrigatoriedade de apresentação do relatório de estudos de estabilidade que garantam as propriedades nutricionais do produto durante todo o prazo de validade, tanto para os alimentos registrados, como para os notificados, exceto embalagens e água do mar dessalinizada. Esse é um requisito bastante importante para o processo de pesquisa e desenvolvimento de produto, e é fundamental que a empresa trabalhe durante o desenvolvimento do produto de forma que a documentação esteja completa para o time de Regulatórios providenciar a regularização dos lançamentos sem impactos no cronograma de Marketing.
É fundamental esclarecer que as seguintes legislações serão revogadas: RDC no 23/2000, RDC no 22/2000 e RDC no 27/2010, que tratam respectivamente de: registro e dispensa da obrigatoriedade de registro, registro de produtos importados e categorias de alimentos e embalagens isentas e com obrigatoriedade de registro. Além dessas normas, serão revogadas a RDC no 240/2018 que altera a RDC no 27/2010 para tratar dos registros e dispensa de registro da categoria suplementos alimentares e a Resolução no 19/1999 que versa sobre registro de alimentos com alegação funcional na rotulagem. Serão revogados, ainda, os seguintes dispositivos regulatórios:
· item 10 do Anexo da Portaria SVS/MS no 34/1998 (Alimentos de transição para lactentes e crianças de primeira infância);
· item 10 do Anexo da Portaria SVS/MS no 36/1998 (Alimentos à base de cereais para alimentação infantil);
· itens 10, 11 e 12 do Anexo da Resolução no 105/1999 (Embalagens e equipamentos plásticos em contato com alimentos);
· parágrafo único do artigo 11 da RDC no 243/2018 (Suplementos alimentares);
· artigo 23 e o Anexo I da RDC no 460/2020 (Fórmulas dietoterápicas para erros inatos do metabolismo).
Por último, em relação ao processo regulatório, o período para o setor produtivo enviar contribuições às Consultas Públicas é de 90 dias e se encerrará em 13/12/2022. As contribuições devem ser enviadas eletronicamente através de formulário específico disponível na página da Anvisa: CP 1113/22 formulário e CP 1114/22 formulário. Segundo a Anvisa, o projeto será concluído em 2023, portanto, as futuras RDC e IN serão publicadas no próximo ano com vacatio legis de 6 meses e prazo de adequação de 12 meses após a entrada em vigor das normas. Desse modo, as empresas terão 18 meses para planejamento e realização das mudanças trazidas pelas novas normas.
Conforme apresentado, há muitas novidades a caminho no que se refere à regularização de alimentos sob competência da Anvisa. O tema é muito importante para as indústrias e para os profissionais que atuam nas áreas diretamente afetadas pelas futuras normas, tais como os times de Assuntos Científicos e Regulatórios, Pesquisa e Desenvolvimento, Marketing, Qualidade, Jurídico, etc. Um dos objetivos do Food Safety Brazil é trazer informação relevante ao setor produtivo para promover a Segurança dos Alimentos; não deixe de acessar as Consultas Públicas no 1113/2022 e no 1114/2022 e de enviar suas contribuições à Anvisa. A participação da indústria no processo regulatório é fundamental para que as futuras legislações atinjam os resultados esperados pelo órgão!
Imagem: foto de Tima Miroshnichenko
7 min leituraEm setembro, a Anvisa publicou as Consultas Públicas no 1113/2022 e no 1114/2022 que tratam respectivamente de proposta de RDC sobre a regularização de alimentos e embalagens sob competência do […]









