4 min leituraVocê quer saber a quantas andam as ações voltadas para a revisão da RDC 12/2001? Leia este post e se atualize!
Para entrar no rol da atividade da ANVISA, as partes interessadas que se tornaram membros a partir de 2015 solicitaram a participação; que já deveria estar em forma de Consulta Pública (CP), pois a Comissão enviou desde março/abril desse ano a nova proposta, mas devido aos problemas burocráticos/jurídicos da ANVISA, isto ainda não se materializou em CP. Na linha do tempo, as etapas foram: em 1987, Portaria DINAL/MS nº1/87, Portaria SVS 451/97, RDC 12/2001, e agora é esperada a Consulta Pública ainda em 2017.
Primeiramente devemos conceituar o que é “Critério Microbiológico” que segundo a definição Codex Alimentarius é “a aceitabilidade de um produto ou lote de alimentos, com base na ausência ou presença, ou no número de microrganismos, incluindo parasitas, e/ou quantidade de suas toxinas ou metabólitos por unidade(s) de massa, volume, área ou lote”.
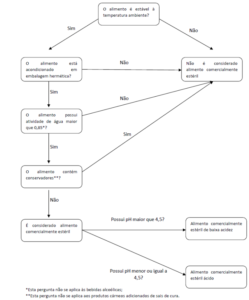
Depois devemos nos perguntar sobre o propósito do critério: quais os componentes? E a resposta é através de indicadores de higiene ou um microrganismo alvo. Qual o ponto da cadeia de produção de alimentos? Quais são os limites microbiológicos para o critério e qual o plano de amostragem? Em que se basear para o plano de amostragem: (tamanho/alíquota), nº de amostras entre m e M(c) e a definição do método analítico.
À luz de tudo isso, em que se basearam para a revisão da legislação de microbiologia de alimentos no Brasil? A resposta é: nos regulamentos internacionais, tais como Codex Alimentarius, União Européia, Canadá, Irlanda, Argentina e Hong Kong.
Foram avaliados: âmbito da aplicação, quais microorganismos, as categorias de alimentos (novos produtos e outros alterados, se comparado com a atual versão da Resolução), amostragem, metodologias analíticas e diretrizes para a aplicação da Norma (para os fiscais das VISAs). O grupo técnico foi composto por integrantes do MAPA, universidades, laboratórios, instituto nacional de metrologia, qualidade e tecnologia, fiscalização de alimentos, gerências de laboratórios de saúde pública, ITAL, ABIA e associações do setor produtivo.
Vale ressaltar que como a RDC12 é aplicável para alimentos prontos para oferta ao consumidor (permanecerá esse objetivo) e não estabelece critérios microbiológicos para matérias-primas, ingredientes e aditivos, pois esses possuem normas próprias; sendo considerados indicadores, deteriorantes e patógenos. Não foram considerados microrganismos de importância duvidosa, por ex.: Aeromonas.
As principais alterações que foram propostas nessa revisão:
– escopo da nova Resolução: produtos prontos para consumo até o final do prazo de validade com padrões de segurança e critérios de higiene, ou seja, as indústrias utilizarão a microbiologia preditiva para saber se a validade mantém o padrão até o final da vida útil quanto ao que é sugerido na Lei (mesmo no último dia da validade deve ele ser adequado para o consumo);
– critérios microbiológicos de higiene: indicadores e de segurança: patogênicos e seus metabólitos; não contemplando: micotoxinas, aditivos, coadjuvantes de tecnologia e produtos destinados pós processamento, além da água de abastecimento proveniente de rede pública, também por estar coberta em legislação específica;
– Aplicação da lei é verificada pela autoridade da saúde;
– Alterações em definições para maior esclarecimento;
– Não foi estipulado um tempo para revisão da Resolução;
– Categorização dos alimentos em relação à resolução anterior priorizando dados locais e de epidemiologia e com base em regulamentos internacionais;
– Na RDC atual há um só anexo (C. termotolerantes) com categorias e padrões e na nova haverá dois anexos (similar ao regulamento da UE), contendo critérios de segurança e outro com critérios de higiene (agora deverão enumerar as Enterobactereaceas e E. coli);
– Plano de amostragem é o mesmo de 2 ou 3 classes, mas mudará o “n”, sendo baseado no risco que o microrganismo apresentar baseado no livro 8 da ICMSF – International Commission on Microbiological Specifications. Ex.: amostragem de 3 classes com os resultados: conforme ou marginalmente aceitável ou não conforme, sendo que, quando der marginalmente aceitável, a indústria terá que rever GMP e HACCP;
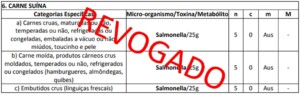
– Os patógenos novos são: não pesquisar Vibrio parahaemolyticus (pesquisa de gen de virulência – não há laboratório no país todo), B. Cereus hemólise + (presuntivo), inclusa L. monocytogenes além de queijos que já aborda, Cronobacter e C. perfringens (não mais sulfito redutores). L. monocytogenes para produtos prontos para consumo pH › 4,4 e Aw › 0,92. Não pesquisar em self service. Cronobacter apenas para fórmulas infantis para lactantes, destinadas a dietas específicas, fórmulas para recém nascidos. S. Aureus enterotoxinas onde a contagem for alta o laboratório terá que detectar toxinas (enterotoxinas estafilocócica acima de 105 UFC/g, mas se for baixa não precisa (pasteurizados/fermentados), principalmente para queijos, leite em pó, requeijão. O C. perfringens deve ser pesquisado diretamente e não sultifo-redutores a 46ºC. Toxinas como histamina em Scombridae (atum, cavala, bonito) que descarboxilam a histidina dando a histamina nos grupos de Enterobacteriaceae maior 50 mg/100g (termoestável e que já consta no Codex Alimentarius utilizado como referência);
– Novas categorias de alimentos: águas envasadas, nozes, amêndoas, cafés e chás para infusão, fórmula para nutrição enteral e fórmulas infantis.
Os desafios para a indústria são entender que os limites são para a comercialização, não podem sair da empresa já com esses limites máximos. Não usar os padrões federais como suas especificações. Para laboratórios de saúde pública entrará Enterotoxinas de Estafilococos, com custo elevado. Em casos de suspeitas de surtos devem pesquisar todos os patógenos (vírus, parasitos) – laboratório deve consultar manual do MS sobre DTA. Indicador de higiene não é patogênico, deve-se pesquisar a E.coli (genes de virulência).
A revisão de novos critérios ou complementares atendendo os progressos de ciência e de tecnologia de alimentos, avaliações de riscos, alterações de microrganismos patogênicos, perfil demográfico dos consumidores (queijo artesanal com leite cru em MG, tipo “queijo da Canastra”, sendo que a Comissão nem discutiu isso, pois é proibido pela legislação da ANVISA), ou seja, não há a definição de tempo.
E você, leitor, o que acha dessas propostas que estão por vir na legislação de microbiologia de alimentos do nosso país? Conte-nos e participe da Consulta Pública quando estiver aberta.
Fonte: SLACA 2017, palestra de Mariza Landgraf da USP.
Imagem: arquivo pessoal da colunista
4 min leituraVocê quer saber a quantas andam as ações voltadas para a revisão da RDC 12/2001? Leia este post e se atualize! Para entrar no rol da atividade da ANVISA, as […]