Em todas as empresas que possuíam sistemas de limpeza e sanitização fechados utilizando Clean in Place (CIP), a necessidade de qualificação e validação desses sistemas mostrou-se crucial para manter um processo produtivo eficiente e higiênico.
Etapas destacadas na validação de sistemas CIP:
- Definição do objetivo de qualificação: É essencial descrever claramente os circuitos e elementos a serem validados e qualificados, estabelecendo os critérios de sucesso para o processo de CIP.
- Avaliação das condições sanitárias: Esta etapa envolve a análise de videoscopia do sistema e o dimensionamento das tubulações e equipamentos conforme normas nacionais e internacionais. Destaca-se a consulta ao documento “Doc. 50 – Hygienic Design Requirements for CIP installations” do EHEDG, que fornece orientações detalhadas sobre o design, gestão e validação de instalações de CIP para assegurar que os elementos a serem validados atendam aos requisitos sanitários. As diretrizes da EFSA, FDA, USDA, além das RDC 275, 3-A Sanitary Standards e ISO 14159, também são consideradas para complementar os padrões de higiene exigidos.
- Capacidade de geração e rastreabilidade de dados: O sistema CIP deve ser capaz de gerar dados confiáveis e rastreáveis, um aspecto fundamental para a gestão analítica e a integridade dos dados durante as etapas do CIP. Para atender aos requisitos do Ministério da Agricultura, Pecuária e Abastecimento (MAPA) e garantir a rastreabilidade e monitoramento eficazes dos processos de CIP, deve-se adotar tecnologias que permitam o registro preciso e confiável de dados, como tempo e temperatura durante o ciclo de limpeza CIP. Um sistema de monitoramento pode ser tanto analógico quanto digital, mas os sistemas digitais oferecem vantagens significativas em termos de precisão, facilidade de acesso aos dados e capacidade de integração com outros sistemas de controle de qualidade.
- Dimensionamento dos parâmetros TACT: Os parâmetros Tempo, Ação Mecânica, Concentração Química e Temperatura (TACT) devem ser corretamente dimensionados com base na tipologia do processo. Isso inclui considerações sobre os tipos de metais a serem limpos, matéria orgânica presente, características de design sanitário e geométrico, além do ambiente de operação. Veja o Anexo 1.
- Consideração das fases do processo CIP: Além do TACT, é crucial entender como cada elemento, como válvulas de dupla sede, se comporta durante o processo. Por exemplo, a fase de pulsação, onde a válvula descarta o químico de limpeza através do dreno para garantir a limpeza de todas as partes em contato com o produto, é vital. Esta etapa está intrinsecamente ligada à programação lógica do sistema CIP.
- Plano de Manutenção: A manutenção do sistema CIP, muitas vezes negligenciada, é essencial. Os sistemas devem ser regularmente verificados e recalibrados para assegurar sua eficácia contínua. Veja o Anexo 2.
- Treinamento de Usuários: Os profissionais envolvidos no sistema de CIP devem receber treinamento contínuo para garantir que possuam o conhecimento necessário para executar o processo de forma eficaz.
Conclusão e Relatório Técnico: Após a conclusão de todas as fases de qualificação e validação do sistema CIP, é importante apresentar um relatório técnico detalhando as necessidades de equipamentos, parâmetros, procedimentos e treinamentos, visando a melhoria contínua do sistema.
Anexo 1:
|
Parâmetro |
Descrição |
Valores Sugeridos |
Considerações Importantes |
|
Tempo (T) |
Duração do processo de limpeza. |
10-60 min. |
Deve ser sempre um balizador das demais variáveis, considerando tipo de matéria orgânica, fases dos elementos e prazos a serem entregues para conclusão da limpeza. Ciclos mais longos podem ser necessários para sujeiras mais difíceis. |
|
Ação Mecânica (A) |
Força física aplicada para remover sujeira. Inclui esfregar e agitar. |
Pressão de 1-3 bar para jatos de água |
Ajustar a pressão para evitar que gere cortina de água, ou spray, correndo o risco de não gerar ação mecânica. A eficácia aumenta com a turbulência e o fluxo direcionado. |
|
Concentração Química (C) |
Proporção de agentes de limpeza no solvente, geralmente água. |
0,5-2% para detergentes 200-400 ppm para sanitizantes |
– Concentrações mais altas não são necessariamente mais eficazes e podem ser mais custosas ou corrosivas. Seguir as recomendações do fabricante do detergente/sanitizante. |
|
Temperatura (T) |
Calor aplicado durante o processo de limpeza |
60-80°C para detergentes 20-45°C para soluções sanitizantes |
A temperatura em detergentes deve sempre estabelecida em conformidade a ficha técnica do fornecedor, sendo possível aumentá-la com base em estudos de reação com a matéria orgânica a ser limpa. Soluções sanitizantes são geralmente aplicadas em temperatura ambiente, para evitar a evaporação do princípio ativo. Recomenda-se sempre usar a temperatura estabelecida pelo fabricante. |
|
Vazão e Turbulência |
Taxa de fluxo do fluido de limpeza através das tubulações e o grau de turbulência gerado. |
Vazão: 1,5-2,5 m/s para tubulações <br> Reynolds > 10.000 para turbulência |
Vazão é extremamente importante para remoção de biofilmes em tubulações, porém deve ser feito o cálculo correto considerando todas as perdas de cargas no circuito onde se realiza o CIP. A vazão deve ser ajustada de acordo com o diâmetro da tubulação para garantir turbulência sem causar erosão ou danos. |
Anexo 2: Cronograma de Manutenção para Sistema CIP
|
Tarefa de Manutenção |
Diariamente |
Semanalmente |
Mensalmente |
Semestralmente |
Anualmente |
|
Limpeza e Sanitização do Sistema |
X |
||||
|
Inspeção Visual (tubulações, tanques, bombas, etc.) |
X |
||||
|
Verificação e Calibração de Sensores (temp, pH, etc.) |
X |
||||
|
Lubrificação de Bombas e Válvulas |
X |
||||
|
Substituição de Vedações e Gaxetas Desgastadas |
X |
||||
|
Verificação da Integridade dos Filtros |
X |
||||
|
Manutenção do Sistema de Controle (software, interfaces) |
X |
||||
|
Revisão do Desempenho do Sistema CIP |
X |
||||
|
Treinamento e Atualização de Funcionários |
X |
Legenda
– Diariamente: atividades que devem ser realizadas a cada ciclo de produção ou no final do dia.
– Semanalmente: Atividades realizadas uma vez por semana para manter a integridade e a eficácia do sistema.
– Mensalmente: Verificações e manutenções regulares que ajudam a prevenir falhas e garantir a operação eficiente do sistema.
– Semestralmente: Inspeções e manutenções mais detalhadas que podem exigir mais tempo e talvez uma parada do sistema.
– Anualmente: Revisões abrangentes do sistema e treinamento de pessoal para assegurar a conformidade com os padrões e a introdução de melhorias.
Referências bibliográficas utilizadas
- – FDA Guidelines (www.fda.gov/)
- – EHEDG Guidelines (www.ehedg.org/)
- – 3-A Sanitary Standards (www.3-a.org/)
- – ISBT Guidelines (www.bevtech.org/)
Obs.: Os valores e recomendações específicos nas tabelas são ilustrativos e devem ser ajustados com base nas especificações do equipamento, nos produtos processados, nos produtos químicos utilizados, nas fichas técnicas dos fornecedores, legislações locais e em outros fatores operacionais específicos do local. É sempre importante consultar um especialista em higiene e processos de limpeza, bem como as diretrizes específicas do fabricante do equipamento, para determinar os parâmetros mais adequados para uma situação específica.
Romulo Seixas Aliende é engenheiro químico e de segurança do trabalho, formado pela UNIFAE e UNIVAS, com trajetória destacada em grandes multinacionais como Ferrero, Danone, PepsiCo, Kerry e Coca Cola FEMSA. Adquiriu experiência internacional significativa nos EUA, liderando operação e projetos de melhoria em sistemas de limpeza e sanitização, segurança comportamental (BBS) e gestão de crises, fortalecendo a resiliência organizacional. Atua como auditor líder de 1ª parte nas certificações FSSC 22000, ISO 14001, SA 8000, OHSAS 18001, ISO 45001 e AIBI.
4 min leituraEm todas as empresas que possuíam sistemas de limpeza e sanitização fechados utilizando Clean in Place (CIP), a necessidade de qualificação e validação desses sistemas mostrou-se crucial para manter um […]




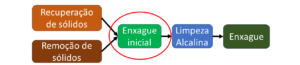 Fig.2 – Etapas de limpeza até enxague da limpeza alcalina
Fig.2 – Etapas de limpeza até enxague da limpeza alcalina

